Razão de Redfield, algas e aquarismo
- Aquários Sobrinho
- 21 de nov. de 2017
- 31 min de leitura
Atualizado: 19 de jan. de 2019
É muito comum encontrarmos em discussões sobre aquarismo uma tabela com uma tal de Razão de Redfield, Proporção de Redfield ou coisa assim, dizendo que se você manter nessa tal proporção haverá uma baixa ou nenhuma incidência de algas no aquário. A Razão de Redfield foi uma grande contribuição para o oceanografia, porém em aquários não pode sequer ser minimamente aplicada, embora os conceitos por trás dos números possam trazer informações e nos ensinar a lidar melhor com nossos aquários.

O que diz os estudos de Redfield sobre nutrientes e microorganismos?
Alfred Clarence Redfield foi um brilhante oceanógrafo e o primeiro a apresentar uma correlação consistente entre a quantidade de nutrientes (carbonatos, nitratos, oxigênio, silica, enxofre e fosfatos) presentes na água do mar com a quantidade desses nutrientes no plâncton. Essa relação ficou conhecida como Redfield Ratio, ou, por tradução direta, Razão de Redfield.
Em 1934, Redfield percebeu e noticiou que a massa média do plâncton marinho tinha composição muito semelhante à composição desses nutrientes na água do mar. Ele assumiu que a proporção média de N:P de 16,7:1,85( para cada 1,85 gramas de fósforo encontrado na água, haviam 16,7 gramas de nitrogênio disponíveis) de era controlado pela necessidade do fitoplâncton desses nutrientes.
A tabela abaixo mostra a média utilizada por Redfield para esse trabalho. Perceba que existem muitos organismos que possuem uma massa bem maior e bem menor do que a média encontrada.

O gráfico abaixo também retirado do trabalho de Redfield publicado em 1934 mostra a incrível correlação entre a quantidade de nitrogênio e a quantidade de fósforo nos oceanos Índico, Pacífico e Atlântico medido em várias profundidades. Veja como a regressão linear é idêntica!
Redfield usa o nitrato como principal fonte de nitrogênio nesse estudo devido ao fato de amônia, nitrito e outras formas de nitrogênio, até mesmo em moléculas orgânicas, estarem em bem menor quantidade em relação ao nitrato.
Considerando isso tudo, Redfield diz que “é como se o mar fosse criado e povoado com animais e plantas e todo o nitrato e fosfato presente na água fosse proveniente da decomposição dessa população original” (tradução livre nossa).
Também são apresentados duas possíveis explicações para esse fato.
A primeira explicação é que a proporção de nitrato e fosfato nos oceanos seria uma média estatística da composição orgânica das diversas comunidades planctônicas e a segunda explicação é que essa proporção é necessária para atividades metabólicas dessas bactérias.
Em 1949 ,Redfield publicou um trabalho estudando a variação no crescimento e na comunidade de fitoplânctons. Nele foi percebido várias coisas e os principais a essa nossa comparação com aquários serão citadas abaixo:
Espécies diferentes de fitoplânctons mantidas em um mesmo ambiente tem uma tendência a manter proporções similares dos elementos essenciais (carbono, nitrogênio e fósforo);
-Independente da tendência de manter uma proporção desses nutrientes em seus organismos, variações ambientais podem fazer com que isso mude;
A quantidade de fósforo variou bastante em relação às algas, inclusive em algas da mesma espécie;
Células jovem e velhas variam bastante de proporção na composição química;
Esse estudo é muito importante e é desconsiderado quando se debate a Razão de Redfield aplicada ao aquarismo. É nesse ponto que começa a aparecer evidências que a Razão de Redfield não tem nada a ver com o surgimento de determinados tipos de algas em função da proporção de nitrogênio e fósforo do aquário ou mesmo do não surgimento de algas.
Isso também foi apresentado em outros estudos posteriores como o trecho abaixo mostra:
“As redes alimentares oceânicas são tipicamente dominadas por microalgas marinhas e bactérias heterotróficas (Campbell et al., 1994, Gasol et al., 1997), e estudos anteriores mostraram que não apenas as relações celulares C: N: P de bactérias e fitoplâncton variam entre diferentes organismos, mas também que a composição elementar de espécies individuais pode variar amplamente em função das restrições ambientais (Herbert 1961; Rhee1973; Geider e La Roche 2002; Vrede et al. 2002)” Tradução livre de um trecho do artigo [8]
Em 1958 Redfield publica um trabalho e talvez o mais proeminente e relevante de todos os seus: The biological control of chemical factors in the environment (em uma tradução livre ficaria como "O controle biológico dos fatores químicos no meio ambiente").
Esse trabalho buscava discutir os pontos em que os microrganismos exerciam uma complexa relação com o oceano e eram responsáveis por manter o nível de nutrientes da água dos oceanos e também o oxigênio atmosférico eram mantidos por essa atividade biológica.
A imagem abaixo, retirado do artigo de 1958, resume grosseiramente o que foi abordado no texto.

Um fato que nos chamou muito atenção foi que Redfiled supõe que os níveis de oxigênio dos oceanos são mantidos pelas bactérias que fazem a redução do sulfato presente na água liberando O2.
Voltando à relação da Razão de Redfield, esse trabalho de 1958 reitera a proporção média (mais uma vez uma média) de C:N:P nos microrganismos de 106:16:1 no oceano aberto. Sublinhamos aqui nesse ponto o termo “oceano aberto” porque há várias menções no trabalho da diferença dessa proporção nas regiões costeiras.
Ele também relaciona que o oxigênio encontrado no plâncton é na mesma proporção da quantidade de oxigênio necessário para oxidar a matéria orgânica do próprio plâncton.
O ponto desse trabalho de Redfield que pode ter inspirado essa relação com os aquários é o ponto em que ele menciona a lei dos mínimos de Liebig onde, nesse ambiente, carbono, cálcio, magnésio, potássio e enxofre não são limitantes devido à sua oferta maior do que a necessidade e nitrogênio e fósforo são encontrados na quantidade mínima para o desenvolvimento do plâncton.
Veremos ao longo desse nosso texto aqui que o mínimo é muito variável e depende uma série de fatores físicos, químicos e biológicos.
Essa relação mínima na Razão de Redfield quer dizer que: se a proporção N:P é menor que 16, o nitrogênio é fator limitante e se a proporção N:P for maior que 16, o fósforo é um elemento limitante.
Agora, apenas analisando esse trabalho de Redfield, manter a proporção de N:P de 16:1 é a manter a melhor proporção para o crescimento do fitoplâncton! Como manter o melhor crescimento pode reduzir a incidência de algas?
Acompanhe o texto e verá que tem um fundo de verdade nessa história que deve ser analisada com cuidado.
A tabela abaixo retirada desse trabalho do Redfield mostra a relação desses elementos no plâncton e na água do oceano. Veja que há uma mínima variação entre o requerido e a composição do plâncton.

Redfield levanta 3 hipóteses (apenas hipóteses, até hoje não há certeza nenhuma do mecanismo certo) para essa situação sendo uma a coincidência geoquímica, a outra uma adaptação dos organismos e a última que processos orgânicos podem de certa forma controlar essas proporções.
O último trabalho do Redfield que vamos rapidamente mencionar nesse nosso texto foi publicado em 1963 e, além de corroborar com o que já dissemos até agora, apresenta dados e considerações sobre a adaptação do plâncton quando este está limitado por nitrogênio ou fósforo, também apresenta com maior detalhe as relações biológicas e também apresenta a relação do silício, muito relevante para as diatomáceas.
Bom, em 2014 o portal Nature lançou uma coletânea de textos mostrando o quanto a teoria apresentada por Redfield evoluiu chamada The Redfield Ratio at 80. Foram apresentados vários artigos sobre o assunto mostrando o que se manteve e o que mudou além de, no editorial, deixar bem claro que os mecanismos biológicos que mantém isso continuam desconhecidos.
Esse material publicado na Nature pode ser acessado no link abaixo. Os que não tiverem acesso e tiverem interesse, pode nos pedir que temos os artigos.
Motivos para a Razão de Redfield não ser aplicada em aquários
Já apresentamos aqui os estudos feitos por Redfield que revolucionaram a forma de pensar as relações bioquímicas dos oceanos, mas agora vamos mostrar todos os pontos que fazem com que isso não tem muita relação com o que dizem nos grupos de aquarismo.
Para uma compreensão mais fácil do restante do texto vamos definir e mostrar alguns conceitos e informações que talvez o leitor não tenha conhecimento.
O que os testes medem: Os testes medem a concentração dos respectivos compostos indicados dissolvido na água do aquário. Todos os testes medem apenas os compostos inorgânicos dissolvidos na água, não medem os compostos orgânicos dissolvidos e nem os compostos imobilizados ou retidos em organismos, substratos, rochas etc.
Bentônico: É aquilo que está associado com o substrato. No caso das algas, são as que não estão flutuando ou livres.
Pelágico: É tudo aquilo que tem relação a estar livre na coluna d’água como fitoplâncton. Um mesmo organismo pode ser encontrado na forma pelágica como na bentônica, varia da capacidade de adaptação desse organismo.
Mesocosmos: É um sistema artificial simplificado. Qualquer aquário é um mesocosmos de um ambiente aquático qualquer. O aquário marinho é um mesocosmos do mar. Um aquário de peixes do Rio Negro ou do Lago Tanganyika é um mesocosmos do seu respectivo ambiente.
Plasticidade: É a capacidade dos organismos de mudar sua fisiologia ou morfologia se adaptando às condições do ambiente.
Alelopatia: É o processo que envolve produção de substâncias que influenciam no crescimento e desenvolvimento de metabolismos diversos. Algas, plantas, fungos e bactérias são capazes de produzir compostos alelopáticos diversos que podem ajudar seu crescimento ou prejudicar o crescimento de organismos competidores.
Eutrófico: ambiente rico em nutrientes.
Oligotrófico: Ambiente pobre em nutrientes.
Fitoplâncton: Comunidade de microrganismos fotossintetizantes que incluem cianobactérias, diatomáceas, dinoflagelados e algas.
Para acelerar a informação iremos usar ( e já usamos) as abreviações C para indicar carbono, N para indicar nitrogênio e P para indicar fósforo.
Agora que definimos esses conceitos importantes, vamos aos fatos!
A plasticidade dos organismos, como foi mencionado pelo próprio Redfield, tem um fator decisivo em mesocosmos diferentes. Essa plasticidade varia de acordo com fatores físicos, químicos e biológicos diversos como temperatura, salinidade, circulação, etc.
As características físicas também desenham papel importante na adaptação dos vários organismos indesejados em várias quantidades de nutrientes.
As cianobactérias são um dos organismos mais adaptáveis que existem, resultado de mais de 2 bilhões de anos de evolução e por isso possuem uma capacidade plástica fantástica.
A imagem abaixo mostra uma foto que parece ser de algas filamentosas, mas são colônias cianobactérias da família Oscillatoriaceae!

As cianobactérias possuem formas de adaptação para diferentes condições ambientais como temperatura, luminosidade, competição com outros organismos e nutrientes[2].
Algumas cianobactérias e algas também podem estocar fosfato para momentos de baixa concentração. [2][3][5]

Cianobactérias podem obter nutrientes do substrato e não somente da coluna d’água[2].
Deixar acumular sujeira no aquário é um prato cheio para algas e cianobactérias que, mesmo que não se aproveitem de restos de comidas e fezes, as outras bactérias e organismos decompositores irão transformar aquela sujeira em nutrientes para esses microrganismos indesejado!
Algumas cianobactérias podem fixar nitrogênio atmosférico, não precisando de amônia ou nitrato. [2][3]
Essa fixação fornece nitrogênio inorgânico aos outros organismos não fixantes como diatomáceos e dinoflagelados. Por isso é comum eles surgirem juntos na natureza e nos aquários.
A fixação de nitrogênio é algo tão importante que pode ser responsável por até 90% da oferta de nitrogênio ao fitoplâncton nos mares[3]. Isso é uma quantidade muito grande. Infelizmente não encontramos nenhuma informação sobre essa influência em ambientes fechados, mas não pode ser desconsiderada.
Algumas espécies de cianobactérias possuem capacidades plásticas muito grandes de adaptar a água eutrófica, oligotrófica[2]. Já foram encontradas cianobactérias se desenvolvendo muito acima da Razão de Redfield. [3][8]
Um dado muito importante é que as explosões de cianobactérias colapsam quando o fósforo passa a ser limitantes[3]. Isso quer dizer que chega um ponto que o consumo de fosfato pelas cianobactérias foi tão grande que se tornou insustentável e as colônias começaram a morrer.
Esse fato das colônias de ciano colapsarem quando o fósforo reduz muito é bem visível nos aquários quando a pessoa diz que colocou removedor de fosfato e as cianobactérias foram diminuindo rapidamente.
Devido ao fato de ficar muito complicado separar todas as informações por tópicos, vamos soltar uma série de dados avulsos que farão muito sentido ao longo do texto. Todos esses dados estão devidamente numerados com as fontes das quais foram retiradas.
O fitoplâncton reduziu em situação de grande oferta de nitrogênio e baixa oferta de fosfato. [2]
Em baixa relação da Razão de Redfield e alta temperatura, prevaleceram microalgas verdes[2]. Esse dado já contradiz uma informação das tabelas da Razão de Redfield que circulam nas conversas de aquarismo.
Dinoflagelados e diatomáceas possuem grande explosões populacionais em ambientes com limitação de nitrogênio liberando grandes quantidades de fósforo inorgânico. [3]
Mesmo com nutrientes não limitantes e próximos à Razão de Redfield, a temperatura adequada é importante para o desenvolvimento dos microrganismos [3].
Zooplâncton ajuda no controle do plâncton, mas tende a evitar colônias de cianobactérias com heterocistos (são células especiais de algumas cianobactérias que fixam nitrogênio do ar na falta de nitrato ou amônia) devido a suas toxinas. [3]
Microfitobentos (algas unicelulares como cianobactérias, diatomáceas e dinoflagelados que se encontram aderidos às plantas, corais, rochas, substrato, etc) possuem uma alta taxa de fotossíntese mesmo com baixa quantidade de nutrientes[4].

Nos estuários há uma grande atividade microbiológica com uma razão de baixo nitrogênio e alto carbono em comparação com a Razão de Redfiled. [4]
Durante as explosões populacionais de algas e cianobactérias num ambiente rico em nutrientes há uma baixa liberação de carbono orgânico devido ao excesso de fotossíntese e o uso desse carbono orgânico no crescimento celular. Quando nitrogênio e fósforo começam a faltar, há um aumento celular do carbono e começa a reduzir o crescimento celular, entra em fase estacionária e a mortalidade excede o crescimento. [4]
Em ambientes ricos em nitrogênio a matéria orgânica liberada pelos seres fotossintéticos (como algas e cianobactérias) possui uma baixa relação C:N, logo uma grande quantidade de compostos nitrogenados, que as bactérias utilizam e liberam amônia para a água que as algas reutilizam. Em um ambiente pobre em nitrogênio, há uma alta relação de C:N na matéria orgânica liberada pelos organismos fotossintéticos, o que faz com que as bactérias tenham poucos compostos nitrogenados à disposição e começam a competir com as algas pelo nitrogênio disponível.
Devido à capacidade de adaptação do fitoplâncton, eles podem ter um ótimo crescimento com uma razão de N:P de 8:1 dos nutrientes disponíveis, porém, na falta de nutrientes, a razão para crescimento ótimo do fitoplâncton seria na proporção de 36: 1 a 45:1. Isso mostra que a taxa de crescimento ótimo varia de acordo com a disponibilidade de nutrientes e outros fatores físicos. [5]
A imagem abaixo retirada do texto [5] exemplifica essa adaptação do fitoplâncton.

A relação de N:P é muito alta em organismos fixadores de nitrogênio talvez seja explicada pelo fato deles precisarem de uma alta concentração de N e uma baixa concentração de P para poderem fixar nitrogênio. [5]
A Razão de Redfield seria apenas uma média geral de diversos fitoplânctons em diferentes condições de crescimento. [5]
A habilidade de um autótrofo crescer depende do seu requerimento de luz para fixar carbono e nitrogênio, determinado por sua relação C/N, e das taxas que recebe luz e nitrogênio do ambiente. Por isso não é de se estranhar diferentes razões de C/N entre os autótrofos. [7]
Microalgas e cianobactérias ainda não possuem uma resposta bem entendida aos efeitos de um sistema rico em nutrientes. [9]
Presença ou não de macroalgas, microalgas e até mesmo luz e sombra promovem uma relação diferente com os compostos orgânicos sedimentares. [9]
Cianobactérias podem usar bicarbonatos como fonte de carbono para a fotossíntese. [10]
Algumas cianobactérias têm seu crescimento reduzido pelo aumento de nitratos e fosfatos, outros apenas pelo aumento de nitrato, outras pelo aumento de fosfato e outras crescem quando nitrato e fosfato estão altos. [12]
Talvez a fato acima explique o caso de pessoas terem dosado nitrato e resolvido problemas de algas e outros microrganismos, promovendo o crescimento de uma microbiota diversa e competindo com os organismos indesejados.
Cianobactérias fixadoras de nitrogênio se associam com diatomáceas num processo de simbiose. As algas diatomáceas consomem o excesso de compostos nitrogenados produzidos pelas cianobactérias e estas podem assim fixar mais nitrogênio gasoso. [13]
A salinidade influencia na competição por nutrientes. Por isso percebemos que aquário de água mole possuem uma maior tendência a criar algas do que aquários de ciclídeos africanos.
Flutuações de CO2 podem permitir um ótimo crescimento de certos organismos e proporcionar uma explosão populacional rápida. Isso é muito comum em aquários plantados com sistemas de CO2 irregular.
Muitos cientistas já noticiaram uma grande capacidade plásticas do fitoplâncton nos oceanos e em laboratório. [15]
Essa quantidade de informação que apresentamos acima mostra uma grande variedade de fatores que podem ser aplicados para explicar o desenvolvimento ou não de algas e outros organismos nos aquários.
É preciso separar organismos bentônicos de organismos pelágicos
As microalgas e macro algas possuem uma diferença absurda na proporção de C:N:P de suas células e recebeu o nome de "Razão de Atkinson".As algas bentônicas tem uma relação mediana de C:N:P de 500:30:1, ou seja, são muito mais limitadas em fósforo do que o fitoplâncton na sua composição física.
Foram analisadas 92 plantas marinhas e obtiveram uma média de 700:35:1 e com uma mediana de 500:30:1, muito diferente do Razão de Redfield de 106:16:1 . A média encontrada em outros 26 trabalhos fica em 430:17:1. Esses números mostram que as algas bênticas possuem concentração de carbono, nitrogênio e fósforo muito diferente das águas dos oceanos.[6][7]

A tabela abaixo retirada da referência [6] compreende uma série de espécies de algas, sendo que alguns gêneros são comuns em aquário. É importante dizer que algumas dessas amostram foram retiradas de locais com baixa quantidade de nutrientes e outros com grandes quantidades de nutrientes onde a única diferença que se mostrou foi na quantidade de carbono dessas algas.

Algumas características que influenciam as algas bentônicas e pelágicas:
As formas morfológicas das algas unicelulares influenciam na absorção de nutrientes. [7]
A forma e rugosidade de plantas bênticas influenciam na absorção de nutrientes e luz.[7]
A absorção da luz influencia na absorção de nutrientes. [7]
As algas unicelulares podem absorver nutrientes por difusão na camada limite ou por absorção na sua superfície celular. Elas absorvem luz de acordo com seu tamanho, forma e pigmentos. [7]
A capacidade de absorção de luz das plantas bentônicas depende do seu dossel (área superior que recebe luz) e da seção de absorção das folhas. Assim como as algas unicelulares, as plantas absorvem nutrientes pela difusão na camada limite ou pela absorção na sua superfície celular, fatores que a rugosidade das algas influencia bastante. [7]
Segundo as considerações dos autores, as plantas bentônicascas absorvem 4 vezes mais nutrientes (a média da relação C:N para as plantas é na média 3 vezes maior que as algas unicelulares) em relação as algas unicelulares em função da mesma quantidade de luz, o que é uma desvantagem das plantas bênticas em relação às algas unicelulares que precisam absorver mais nutrientes. E, apenas em condições onde algas unicelulares muito grandes e em baixa turbulência da água e as plantas bentônicas em alta turbulência (leva mais nutrientes para as algas), acontece o caso das algas unicelulares e as plantas terem a mesma absorção em relação à luz. [7]
As restrições físicas como a luz e captação de nutrientes pode ser aplicada a uma grande gama de seres autótrofos. [7]
Importante mencionar que isso não se aplica a todas as condições ambientais.
Talvez, pela análise desses pontos, é que sejam mais comuns infestações de unicelulares do que de algas macrófitas nos aquários, devido a eles serem menos limitadas por nutrientes e luz.
Para compreendermos melhor ainda essa relação de nutrientes e microrganismos, vamos apresentar conceitos que não existiam ou não foram considerados na época que Redfield apresentou seus trabalhos.
Co-limitação
A limitação de crescimento do fitoplâncton é um mecanismo complexo demais e a adição de um ou vários fatores podem se auto influenciar, denominado pelo autor de co-limitação e aparece em duas condições.

A primeira co-limitação é a bioquímica, onde a adição de um elemento limitante facilita o acesso ou assimilação de outro recurso (anteriormente) limitante. A segunda co-limitação é a de comunidade onde um grupo de fitoplâncton pode responder a um elemento limitante enquanto outro grupo pode responder a outro fator limitante. [5]
A co-limitação bioquímica depende da abundância de um nutriente (A) no meio e de um suporte metabólico para assimilar e transportar esse nutriente para a célula. Geralmente o cofator limitante, geralmente um elemento traço (B), é responsável por essa assimilação e transporte. Assim, adicionando qualquer um dos dois, você aumenta o crescimento do fitoplâncton. [5]
Um exemplo de co-limitação bioquímica é a relação do ferro e da luminosidade. Aumentando a luz ou a quantidade de ferro, você aumenta o crescimento do fitoplâncton já que o ferro é um elemento essencial para o aproveitamento dos baixos níveis de luminosidade. É preciso deixar claro que existem condições variáveis de cada espécie envolvida[5].
Outro exemplo de co-limitação bioquímica é entre o zinco e o fosfato orgânico. O zinco é fundamental para o aproveitamento do fosfato orgânico pelo fitoplâncton. [5]
O exemplo mais conhecido de co-limitação de comunidade acontece entre cianobactérias em um ambiente oligotrófico sem limitação de ferro onde as cianobactérias fixadoras de nitrogênio são abundantes. Se você adiciona nitrato, você estimula as cianobactérias não fixadoras do grupo a se desenvolverem. Se você adiciona fosfato, você estimula o crescimento de cianobactérias fixadoras de nitrogênio. [5]
Razão Crítica de N:P
Com o passar dos anos foi desenvolvido o conceito de Razão Crítica de N:P que significa a proporção de nitrogênio e fósforo celular em que o organismo estará limitado por esses dois elementos simultaneamente. Acima desse limite os organismos estarão limitados pelo fósforo e abaixo desse limite limitados pelo nitrogênio.
Essa Razão Crítica é parecida com a Razão de Redfield sob o ponto de vista que na Razão de Redfield uma relação de N:P maior que 16 indica uma limitação de fósforo e uma relação de N:P menor que 16 indica uma limitação de nitrogênio.
Diferente da Razão de Redfield, a Razão Crítica não está necessariamente ligada com uma maior ou menor taxa de crescimento ou com a quantidade de nutrientes no ambiente. Na Razão de Redfield, a razão de 16:1 de N:P é dita como a melhor para o crescimento do fitoplâncton, enquanto que a Razão Crítica varia de acordo com a fase de crescimento dos organismos.
Um ponto muito importante a se levantar é que o que vai determinar essa razão crítica de N:P são as condições ambientais que vão fazer com que as células tenham essa variação de nitrogênio e fósforo. Isso corrobora com o que é dito no artigo [5] sobre as fases de adaptação do fitoplâncton e sua relação com o nitrogênio e fósforo celular.
A imagem abaixo retirada do artigo [15] mostra o ponto da Razão Crítica de uma microalga bastante comum, inclusive em aquários, da espécie Scenedesmus. Note que à esquerda do ponto crítico que você pode aumentar a quantidade de fosfato que não vai alterar a taxa de crescimento da alga. Á direita do ponto crítico da para perceber que independente do quanto aumente a disponibilidade de nitrogênio na célula, não aumenta a taxa de crescimento.

Para melhorar a compreensão do gráfico acima apresentamos o gráfico abaixo retirado do artigo [17] mostra o quanto varia a concentração de nitrogênio e fósforo dentro da célula em função do aumento da relação N:P do meio. O Ponto Crítico é onde as duas curvas se cruzam.

Outro ponto interessante sobre esse assunto é que a taxa de crescimento do fitoplâncton pode se manter constante mesmo com uma grande variação na disponibilidade de nitrogênio e fósforo do meio.
A taxa de crescimento de um organismo é a velocidade com que ele se reproduz. Os gráficos acima mostraram uma alga que se divide a uma taxa que vai de zero a 0,8 vezes por dia (que significa que se divide a cada 30 horas!).
O gráfico abaixo retirado do texto [16] mostra que, mesmo com variações na relação de nitrogênio e fósforo do meio, a taxa de crescimento de uma outra microalga pode se manter. A relação de fósforo na célula varia para se adaptar à variação do meio e mantém a sua taxa de crescimento.

Um ponto importante sobre o gráfico acima é que chega em um determinado ponto, onde o aumento no nitrogênio disponível no meio não reduz a quantidade de fósforo nas células. Esse ponto os pesquisadores chamam de “parcela mínima” de fósforo das células. Nesse ponto de parcela mínima, quanto menor o fosfato, menor a velocidade de crescimento.
Muito importante prestar atenção que quanto maior a concentração de fosfato na célula, maior a taxa de crescimento, embora existam ponto onde que com a mesma quantidade de fosfato houve crescimento diferente. E segundo ao que já dissemos no texto aqui, a concentração do fosfato na célula aumenta quando se diminui o nitrogênio disponível.
É importante frisar que as diversas espécies de fitoplâncton possui uma variedade de adaptação diferente com que faz que essa relação N:P do meio e do interior de suas células varie bastante, mas sempre quanto menor for o fosfato disponível, menor a capacidade de transformação de biomassa.
Mixotrofia
Em alguns casos nos aquários, mesmo com testes de fosfato muito baixos, acontece de algumas algas surgirem em grande quantidade e o aquarista fica sem saber o motivo.
Acontece que o teste mede apenas o fosfato inorgânico dissolvido na água e não o fosfato orgânico dissolvido na água e muito menos o fosfato presente nas células de algas e bactérias.
Mixotrofia é a capacidade do organismo ser autotrófico e heterotrófico ao mesmo tempo.
Isso quer dizer que o organismo pode produzir seu alimento a partir de matéria inorgânica ou utilizar compostos orgânicos para isso!
Um dos meios que as algas encontraram de conseguirem fosfato em lugares com baixos níveis de fosfato dissolvido é se alimentando de bactérias! Isso mesmo, existem algas que comem bactérias e/ou de carbono orgânico do meio!
O fitoplâncton no geral pode usar de compostos orgânicos como fonte de nutrientes, inclusive nitrogênio e fósforo.
Uroglena americana é uma microalga que se alimenta de bactérias e causa frequentes explosões populacionais em lagos do Japão mesmo com o lago em baixo nível de fosfato na água. [18]
O vídeo abaixo publicado na página oficial do Museu Americano de História Natural explica um pouco desse processo e curiosos podem partir dali para novas pesquisas.
Muitas algas também podem inclusive usar compostos simples de carbono como açúcares, álcoois e acetatos como fonte de energia[19][20][21]! Isso é muito usado hoje na produção de biomassa a partir de microalgas com finalidades diversas, até mesmo combustível.
Variações da Relação de Redfield em diversas outras situações
Com o passar dos anos foram sendo descobertas muitas variações na Razão de Redfield e algumas vamos apresentar abaixo.
A tabela abaixo retirada do artigo [8] mostra a diferença da quantidade de carbono encontrado numa espécie de cianobactéria. É nítida a variação da quantidade de carbono celular da cianobactéria em questão em diferentes trabalhos evidenciando à capacidade plástica em função das variações do meio.

A tabela abaixo também retirada do artigo [8] mostra as proporções de carbono, nitrogênio e fósforo em cianobactérias em regimes com muito ou pouco nutrientes.

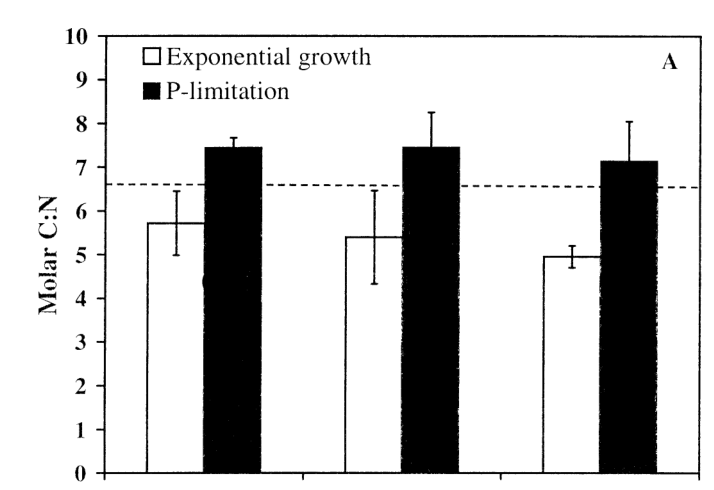
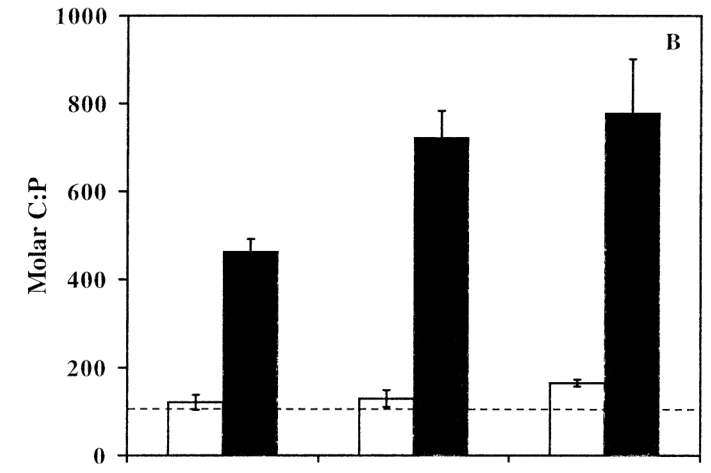
Os gráficos abaixo, também do artigo [8], mostram a concentração na célula das cianobactérias comparando uma cultura em crescimento exponencial e uma cultura com limitação de fósforo. A linha pontilhada horizontal é a Razão de Redfield. É possível perceber que a concentração de C, N e P que essas cianobactérias divergem da Razão de Redfield.

O apontamento mais importante que podemos tirar do artigo [8] é o fato de mencionarem que organismos de crescimento lento, como as espécies das cianobactérias do estudo, precisam de uma quantidade de fósforo menor do que os organismos de crescimento rápido.
Vendo todos esses trabalhos, comparações e informações acabamos por corroborar o que sempre dizemos. Mantenha sempre os níveis de nitrato e fosfato o mais baixo possível para evitar grandes surtos de algas e bactérias. Induza a competição e favoreça aqueles que vocês querem no aquário, como plantas ou corais, porque favorecendo um, você acaba desfavorecendo o outro. Pense em acrescentar animais que ajudem a controlar algas e bactérias à sua fauna, a predação é um fator que traz bons resultados. Não se esqueça de manter a iluminação e circulação e água adequadas, pois esses são os fatores físicos mais importantes.
Um ponto muito importante é que os nutrientes como carbono, fósforo e nitrogênio não precisam estar dissolvidos na água, que é o que os nossos testes de aquários nos mostram, ele pode estar sedimentado no substrato, rochas e outras superfícies.
Fatores físico como temperatura, iluminação, duração do dia, salinidade, concentração de nutrientes e outros fatores influenciam na composição celular do fitoplâncton em ambiente com nutrientes à disposição. [15]
A absorção de fosfato depende de fatores físicos como taxa de iluminação como mostra a imagem abaixo retirada do artigo [14]. A imagem abaixo mostra essa variação na absorção do fosfato em função da luz.

A circulação é um fator que interfere no carregamento de nutrientes para todos os organismos na água. Águas paradas tendem uma pior difusão de nutrientes. Águas agitadas tem uma maior difusão de nutrientes.
A imagem abaixo retirada do artigo [15] mostra a variação da composição celular em culturas de laboratório de microalgas marinhas e cianobactérias (A e B), a composição do particulado marinho (C e D) e a absorção de nutrientes durante explosão de fitoplâncton. Mais uma vez a maioria foge da Razão de Redfield, mas a média fica bem próxima dessa média.

O fato que mais chama atenção em ambientes com limitação de nitrogênio é fato do crescimento da relação C:N e a redução da relação N:P e o crescimento da proporção C:P e N:P em organismos com limitação de fósforo. [15]
Competição entre organismos
Os seres autotróficos e heterotróficos competem entre si por nutrientes no geral. Nós já falamos muito disso nos nossos textos sobre nitrificação onde as bactérias nitrificantes, com seu crescimento lento, perdem para as bactérias heterotróficas, de crescimento rápido, na briga por espaço, oxigênio e elementos traços.
A tabela abaixo retirada do artigo [17] mostra um diagrama relacionando a adição de nitrogênio e fósforo ao meio e a predominância de dois organismos diferentes. Nota-se que até o ponto de N:P igual a 10 há a predominância do organismos A; entre 10 e 20 os organismos coexistem juntos limitados por nitrogênio ou fósforo; acima de 20 há a predominância do organismo B.

Essa relação de predominância depende de fatores físicos, químicos e biológicos diversos. Não há uma faixa onde microrganismos estarão todos limitados, como dizem comumente nos grupos de aquarismo usando a Razão de Redfield como base.
A tabela abaixo é a comumente propagada nas discussões de aquarismo onde assumem que mantendo a Razão de Redfield há uma baixa incidência de algas, porém, como já vimos aqui, isso não tem base técnica nenhuma. Os organismos se adaptam, utilizam outras fontes além dos nutrientes dissolvidos, sofrem influências físicas, químicas e biológicas que torna impossível criar uma tabela padrão para todos os casos.

É muito comum relatos de gente que usou essa tabela e deu certo, gente que usou e deu errado, mas não há nenhuma certeza se foi devido à redução dos nutrientes, ao incentivo à competição ou a qualquer outro motivo que passou despercebido ao aquarista.
Como apresentamos durante todo o texto, a capacidade de adaptação dos organismos é muito grande frente às várias variáveis.
O gráfico abaixo retirado do texto [22] mostra a competição entre uma bactéria heterotrófica e uma microalga quando se adiciona açúcar no meio de cultura. Percebe que quando a concentração de açúcar é baixa, há uma predominância da microalga e à medida que se aumenta a concentração de açúcar a bactéria passa a predominar. Quando a proporção de carbono e fósforo chega a certo ponto, a alga perde a batalha e a bactéria passa a ser o único organismo dominante.

Essa relação de carbono também é frequentemente discutida nos grupos de aquarismo marinho devido ao uso de açúcar ou vodka para controlar o fosfato e reduzir algas. O maior problema da não repetibilidade dessas concentrações é que a comunidade microbiológica é única em cada aquário e assim você não sabe a quem está favorecendo ao certo.
Caso a concentração de carbono adicionada seja muito grande pode prejudicar a nitrificação (mais importante em água doce que no marinho com uso de skimmer) como também o surgimento de organismos indesejados. Como comentamos, existem organismos mixotróficos e entre eles estão uma grande quantidade de cianobactéria e diatomáceas. Assunto amplamente debatido no artigo [23].
Um fator competitivo muito grande dos organismos heterotróficos sobre os autotróficos é a sua grande e rápida capacidade de reprodução. Muitos organismos heterotróficos podem se dividir em minutos, quanto os autotróficos podem demorar mais de um dia. Isso pode representar uma diferença populacional incomparável!
Já dissemos muito organismos competem entre si e muitos deles usam o que podem como sua forma, predação, adaptações na sua constituição celular, rápida taxa de crescimento e até mesmo o uso de substâncias que podem ser nocivos aos outros competidores, a alelopatia.
A imagem abaixo retirada do artigo [24] mostra o efeito da “guerra química” de um dinoflagelado com outros microrganismos diversos causando a destruição da célula “inimiga”.

Críticas abertas à Razão de Redfield
Existem muitos trabalhos que criticam a Razão de Redfield apontando fatos ignorados ou desconhecidos por Redfield na sua época.
Existem vários casos que a Razão de Redfield não se aplica, seja pela capacidade de estocar nutrientes do fitoplâncton, metabolismo microbiológico (fixação de nitrogênio, nitrificação e desnitrificação). [5]
O texto [25] aponta os seguintes pontos como mecanismos de adaptação quando a relação de N:P está alta, ou seja, há limitação de fósforo da comunidade de fitoplânctons:
Usar menos fósforo que os outros organismos competidores ou compostos que não possuem fósforos (lipídios, por exemplo) para desempenhar a mesma função;
Usar uma fonte alternativa de fósforo em relação aos competidores como fósforo imobilizado no substrato ao invés de dissolvido;
Usar da Mixotrofia para conseguir nutrientes que precisa;
Absorver nutrientes necessários e eliminar os desnecessários;
Manter estratégias de defesa para manter a baixa taxa de crescimento (a alelopatia é o fator decisivo nesse ponto);
Usar o próprio metabolismo pra criar um micro-ambiente favorável (falamos disse no nosso texto sobre as cianobactérias!);
O texto [25] também aponta os mecanismos de adaptação quando a relação de N:P está baixa, ou seja, há limitação de nitrogênio no meio e são as mesmas apontados quando o fósforo é limitante, com exceção da possibilidade de fixar N2.
Redfield baseou sua ideia levando em conta a média constante de N:P nas águas profundas do oceano onde essa concentração na água se mantinha bem próximo a 16:1, porém, na água doce, isso não é nada comum.
A imagem abaixo retirada do texto [26] mostra a relação de N:P do lago Tanganyika de acordo com a sua profundidade. É visível eu a variação dessa relação é muito grande nas camadas superiores e tende variar menos à medida que a profundidade aumenta. É importante mencionar que o Lago Tanganyika, lar de muitos ciclídeos usados no aquarismo, se torna anóxico pro volta dos 100 metros de profundidade e, diferente dos oceanos nessa condição, a relação de N:P é muito baixa.

Estudos posteriores usando de uma maior base de dados de medições das águas em diversas partes do mundo encontrou uma média global de C:N:P dos particulados orgânicos de 163:22:1, cerca de 40% maior que a média de Redfield como mostra o artigo[27] publicado na Nature que utilizou mais de 100 mil medições para chegar a esse resultado.
As tabelas do artigo [27] comparando as médias encontradas pode ser vista abaixo. Veja como há uma grande variação de valores médios encontrados, muitos deles devido a fatores geográficos e biológicos diversos.

Nos aquários e outros ambientes fechados (mesocosmos) a razão de Redfield pode proporcionar um ambiente propício ao surgimento de certas comunidades em detrimento de outra devido às suas limitações espaciais e biológicas, muito diferente da disponível nos oceanos onde a razão de Redfield é muitas vezes mantida. Você não possui nos aquários a mesma biodiversidade de zooplâncton e fitoplâncton que existe na natureza, fatores que ajudam no controle de diversas explosões populacionais.
Considerações finais
Com todos esses dados aqui apresentados a única coisa que queremos deixar claro é que não há tabelas ou fórmulas que vão manter os aquários de livres de algas! Não é sequer possível isso sem manter o aquário completamente esterilizado.
Muitos aquaristas acham ou desejam que seus aquários fiquem exatamente como eram no dia da montagem. Tudo limpinho, tudo branquinho. Mas, isso nunca acontece. Se o aquário estabilizar como um bioma, nunca vai ficar branquinho. No aquário (e na natureza) quase tudo que está branquinho está morto.
Então, muitos aquaristas perdem seus peixes, corais e até o aquário todo porque, ao primeiro sinal de alga ou ciano, correm desesperados para colocar remédios, produtos ou fazer ações radicais. Ficam literalmente paranoicos.
Quem entra no aquarismo, principalmente o marinho,precisa entender e aceitar que pequenos focos de algas ou de ciano são parte da natureza e parte do aquário.
Não tem como ter aquário bom que seja 100% livre disso.
Qualquer ação radical vai ser sempre pior do que um tufinho de alga em algum cantinho do aquário. Não só será pior, como será ineficaz.
Vale sempre lembrar a marcante frase daquele personagem do filme Jurasic Park - "A vida encontra um meio".
Os mecanismos que regem o surgimento e desaparecimento das algas assim como sua capacidade de adaptação são imprevisíveis devido ao alto nível de variáveis possíveis!
O principal intuito desse texto é fornecer ao aquarista uma forma mais ampla de compreender o que acontece em seu aquário em relação a algas, competição e disponibilidade de nutrientes.
A Razão de Redfield se mostra apenas uma média estatística nas águas profundas dos oceanos e muitas vezes não se repete em outros lugares na natureza e nem em laboratório. Ela não deve ser usada como parâmetro envolvendo um ambiente fechado como os aquários.
Cada aquário é um mesocosmos diferente com características físicas, químicas e biológicas que o tornam único com condições de equilíbrio e de favorecimento das algas e outros microrganismos específicos.
Vimos que os organismos possuem capacidade de se adaptar de acordo com a luz, temperatura, salinidade, concentração de nutrientes diversos, oxigenação, contaminantes, correnteza, associação com outros microrganismos, associação com plantas, corais e animais. Então cabe ao aquarista mexer nas variáveis que controla e tentar encontrar um equilíbrio que lhe é agradável e lhe vai trazer os resultados desejados.
A única coisa certa é quanto menor a quantidade de nutrientes disponíveis, menor é a quantidade de microrganismos que podem surgir. Então o aquarista deve ficar atento para manter o mínimo necessário de nutrientes para o bem-estar de seus animais e plantas.
Os aquaristas não possuem os meios de analisar o tipo das algas e bactérias que existem no seu aquário, muito menos encontrar Razões Críticas. Tampouco podem medir o fósforo, nitrogênio e carbono orgânico no aquário. A não possibilidade de medir todas as variáveis, que já em difícil mesmo em laboratório, não permite muitas certezas. Não conhecemos ninguém que meça CO2 no aquário marinho, sendo ele ainda a principal fonte de carbono para o fitoplâncton.
O método que serviu para controlar determinado problema em um aquário pode não servir em outro e não há nada de errado nisso. O aquarista deve ir com o tempo vendo o que funciona em seu aquário e o que não funciona. Paciência e perseverança são as principais virtudes do aquarismo.
Muitos casos da adição de nutrientes como fosfato e nitrato ao aquário reduziu o problema de algas problemáticas induzindo a competição, mas isso não quer dizer que sempre vai acontecer igual. Existem casos que adicionar esses nutrientes podem causar sérios problemas.
Fosfato e nitrato não são vilões por si só, há um conjunto enorme de variáveis influenciando ou não o surgimento de algas.
Vimos que uma água bem oxigenada e sem acúmulo de detritos (fonte orgânica e inorgânica de nutrientes diversos) reduz em muito a incidência de algas e cianobactérias. Esse é o principal efeito dos ozonizadores ou do Oximax, equipamentos que aumentam o oxigênio disponível e oxidam a matéria orgânica, seja diretamente ou pelo favorecimento ao crescimento de microrganismos heterotróficos.
Induzir a competição de forma favorável é um dos melhores meios de controlar os organismos indesejados. Herbívoros como camarões, paguros, snails, cascudos, otocinclus (comem diatomáceas), caramujos e outros são excelentes formas de controlar algas indesejadas.
Plantas, corais e algas calcárias, além de competirem por nutrientes com algas e outros microrganismos, ajudam a eliminar por alelopatia, que, como vimos, pode literalmente destruir as células adversárias.
Para despertar interesse nesse assunto de competição entre plantas e fitoplâncton, o texto [28] mostra como os compostos alelopáticos produzidos pela Myriophyllum spicatum, conhecida no aquarismo como pinheirinho, inibem o crescimento de uma espécie de cianobactérias. Se você cria condições adequadas para as plantas, elas acabam competindo e ganhando do fitoplâncton. Esse é um dos ótimos motivos para se ter plantas vivas no aquário.
Plantas, corais e algas pinks bem cuidados ajudam no controle do fitoplâncton e de macroalgas!
Ainda falando das plantas, caso elas não estejam em condições para seu desenvolvimento como falta de nutrientes, muito comum falta de CO2 ou ele em concentrações inadequadas, promovem o desenvolvimento de algas e outros organismos indesejados.
Em relação à filtragem, isso tudo mostra que um skimmer bem dimensionado é o melhor equipamento de filtragem que se pode ter. Ele remove microrganismos e matéria orgânica definitivamente do sistema. Por isso processos que promovem o crescimento de microoganismos com adição de carbono orgânico precisam de um bom skimmer para dar certo e é isso que torna a maioria desses processos ineficientes em aquários de água doce.
É preciso tomar cuidado com o carbono orgânico adicionado ao aquário. Ele possui prós e contras que devem ser considerados. Entre os prós estão induzir a competição com as algas, mas os ele pode causar problemas como branqueamento de corais e adoecimento de peixes caso o crescimento das bactérias seja excessivo.
O carbono orgânico favorece a desnitrificação (embora não dissemos no texto, é imprescindível a presença de carbono orgânico para que ocorra o processo da desnitrificação já que passa a ser a fonte de carbono dessas bactérias), porém prejudica a nitrificação. Ele ajuda na competição com o fitoplâncton, porém pode desencadear uma explosão de bactérias e fungos caso não seja usado corretamente.
A melhor forma de aplicar carbono orgânico é pelos biopellets, pois, diferente dos outros métodos, você pode remover caso esteja em excesso.
Também é importante não confundir nesse caso o carbono orgânico usado para o crescimento de bactérias heterotróficas (açúcar, vodca, biopellets,etc) com o carbono orgânico usado nos aquários de água doce (Excel, RC Flora Carbo, etc.) como fonte de carbono para as plantas. São formas de carbono orgânico muito diferentes e com finalidades diferentes.
Bom, isso tudo foi só uma introdução confusa apresentada por nós a um debate praticamente infinito de possibilidades, variedades de organismos e metodologias.
Passamos meses juntando informação e semanas tentando condensar tudo em um texto de com relativa facilidade de compreensão para apresentar aos aquaristas uma compreensão maior das variáveis que giram em torno de seus aquários.
Temos todos as referências e textos complementares disponíveis para quem pedir e iremos compartilhar de bom grado. Só dos textos apresentados aqui já é possível ocupar uma cabeça ativa por semanas ou meses! Cada texto apresentado aqui tem ao menos uma dezena de outras referências com informações diversas que só dependem do leitor para serem lidas.
É uma pena que quase não existam textos em português sobre o assunto, mas fazemos o máximo possível para trazer os dados e informações importantes ao alcance de nossos leitores.
Existem muitos artigos que mereciam textos inteiros (e provavelmente devem ganhar no futuro), mas, devido à extensão que tomaria se apresentássemos mais detalhes, ficamos apenas no básico.
Esperamos que esse texto seja apenas o início de um debate elevando o nível de informação sobre a relação das algas, cianobactérias, diatomáceas, dinoflagelados com a disponibilidade de nutrientes e características físicas e químicas do aquário. Chega de perpetuar informações incompletas como se fossem verdadeiras.
Agradecemos o Rafael Compassi pelas suas contribuições na revisão desse texto!
Referências e textos complementares
Redfield, Alfred Clarence. "On the proportions of organic derivatives in a sea water and their relation to the composition of plankton." James Johnstone memorial volume (1934): 177-192.
Ketchum, Bostwick H., and Alfred C. Redfield. "Some physical and chemical characteristics of algae growth in mass culture." Journal of cellular physiology 33.3 (1949): 281-299.
Redfield, Alfred C. "The influence of organisms on the composition of seawater." The sea 2 (1963): 26-77.
[1] Redfield, Alfred C. "The biological control of chemical factors in the environment." American scientist 46.3 (1958): 230A-221.
[2] Komárkova, Jaroslava, R. Ladares-Silva, and Pedro Americo Cabral Senna. "Extreme morphology of Cylindrospermopsis raciborskii (Nostocales, Cyanobacteria) in the Lagoa do Peri, a freshwater coastal lagoon, Santa Catarina, Brazil." ARCHIV FUR HYDROBIOLOGIE-SUPPLEMENT- 129 (1999): 207-222.
[3] Walve, Jakob, and Ulf Larsson. "Blooms of Baltic Sea Aphanizomenon sp.(Cyanobacteria) collapse after internal phosphorus depletion." Aquatic Microbial Ecology 49.1 (2007): 57-69.
[4] Cook, Perran LM, et al. "Effect of nutrient availability on carbon and nitrogen incorporation and flows through benthic algae and bacteria in near-shore sandy sediment." Aquatic Microbial Ecology49.2 (2007): 165-180.
[5] Arrigo, Kevin R. "Marine microorganisms and global nutrient cycles." Nature 437.7057 (2005): 349-355.
[6] Atkinson, M. J., and S. V. Smith. "C: N: P ratios of benthic marine plants." Limnology and Oceanography 28.3 (1983): 568-574.
[7] Baird, Mark E., and Jason H. Middleton. "On relating physical limits to the carbon: nitrogen ratio of unicellular algae and benthic plants." Journal of Marine Systems 49.1 (2004): 169-175.
[8] Bertilsson, Stefan, et al. "Elemental composition of marine Prochlorococcus and Synechococcus: Implications for the ecological stoichiometry of the sea." Limnology and oceanography48.5 (2003): 1721-1731.
[9] Hardison, A. K., et al. "Microphytobenthos and benthic macroalgae determine sediment organic matter composition in shallow photic sediments." Biogeosciences 10.8 (2013): 5571-5588.
[10] Merz, Martina UE. "The biology of carbonate precipitation by cyanobacteria." Facies 26.1 (1992): 81-101.
[11] Emerson, Steven, Sabine Mecking, and Jeffrey Abell. "The biological pump in the subtropical North Pacific Ocean: Nutrient sources, Redfield ratios, and recent changes." Global Biogeochemical Cycles 15.3 (2001): 535-554.
[12] Ernst, Anneliese, et al. "Nitrate and phosphate affect cultivability of cyanobacteria from environments with low nutrient levels." Applied and environmental microbiology 71.6 (2005): 3379-3383.
[13] Foster, Rachel A., et al. "Nitrogen fixation and transfer in open ocean diatom–cyanobacterial symbioses." The ISME journal 5.9 (2011): 1484-1493.
[14] Fu, Fei‐Xue, et al. "Phosphate uptake and growth kinetics of Trichodesmium (Cyanobacteria) isolates from the North Atlantic Ocean and the Great Barrier Reef, Australia." Journal of Phycology 41.1 (2005): 62-73.
[15] Geider, Richard J., and Julie La Roche. "Redfield revisited: variability of C [ratio] N [ratio] P in marine microalgae and its biochemical basis." European Journal of Phycology 37.1 (2002): 1-17.
[16] Terry, Kenneth L., Edward A. Laws, and Deborah J. Burns. "Growth rate variation in the N: P requirement ratio of phytoplankton." Journal of Phycology 21.2 (1985): 323-329.
[17] Rhee, G-Yull. "Effects of N: P atomic ratios and nitrate limitation on algal growth, cell composition, and nitrate uptake." Limnology and oceanography 23.1 (1978): 10-25.
[18] Urabe, Jotaro, Tek Bahadur Gurung, and Takehito Yoshida. "Effects of phosphorus supply on phagotrophy by the mixotrophic alga Uroglena americana (Chrysophyceae)." Aquatic Microbial Ecology 18.1 (1999): 77-83.
[19] Abeliovich, Aharon, and D. O. R. I. T. H. Weisman. "Role of heterotrophic nutrition in growth of the alga Scenedesmus obliquus in high-rate oxidation ponds." Applied and environmental microbiology 35.1 (1978): 32-37.
[20] Arenovski, Andrea L., Ee Lin Lim, and David A. Caron. "Mixotrophic nanoplankton in oligotrophic surface waters of the Sargasso Sea may employ phagotrophy to obtain major nutrients." Journal of Plankton Research 17.4 (1995): 801-820.
[21] Bhatnagar, Ashish, et al. "Renewable biomass production by mixotrophic algae in the presence of various carbon sources and wastewaters." Applied Energy 88.10 (2011): 3425-3431.
[22] Brown, Edward J., Don K. Button, and Douglas S. Lang. "Competition between heterotrophic and autotrophic microplankton for dissolved nutrients." Microbial ecology 7.3 (1981): 199-206.
[23] Burkholder, JoAnn M., Patricia M. Glibert, and Hayley M. Skelton. "Mixotrophy, a major mode of nutrition for harmful algal species in eutrophic waters." Harmful algae 8.1 (2008): 77-93.
[24] Tillmann, Urban, Uwe John, and Allan Cembella. "On the allelochemical potency of the marine dinoflagellate Alexandrium ostenfeldii against heterotrophic and autotrophic protists." Journal of plankton research 29.6 (2007): 527-543.
[25] Glibert, Patricia M., and JoAnn M. Burkholder. "Harmful algal blooms and eutrophication:“strategies” for nutrient uptake and growth outside the Redfield comfort zone." Chinese Journal of Oceanology and Limnology 29.4 (2011): 724-738.
[26] Hecky, R. E., and Peter Kilham. "Nutrient limitation of phytoplankton in freshwater and marine environments: a review of recent evidence on the effects of enrichment." Limnology and Oceanography 33.4part2 (1988): 796-822.
[27] Martiny, Adam C., Jasper A. Vrugt, and Michael W. Lomas. "Concentrations and ratios of particulate organic carbon, nitrogen, and phosphorus in the global ocean." Scientific data1 (2014): 140048.
[28] Zhu, Junying, et al. "Study on the mechanism of allelopathic influence on cyanobacteria and chlorophytes by submerged macrophyte (Myriophyllum spicatum) and its secretion." Aquatic Toxicology 98.2 (2010): 196-203.
Caraco, Nina, Jonathan Cole, and Gene E. Likens. "A comparison of phosphorus immobilization in sediments of freshwater and coastal marine systems." Biogeochemistry 9.3 (1990): 277-290.
Cleveland, Cory C., and Daniel Liptzin. "C: N: P stoichiometry in soil: is there a “Redfield ratio” for the microbial biomass?." Biogeochemistry 85.3 (2007): 235-252.
Furnas, Miles, et al. "In the other 90%: phytoplankton responses to enhanced nutrient availability in the Great Barrier Reef Lagoon." Marine pollution bulletin 51.1 (2005): 253-265.
Drakare, Stina. "Competition between picoplanktonic cyanobacteria and heterotrophic bacteria along crossed gradients of glucose and phosphate." Microbial ecology 44.4 (2002): 327-335.
Advances in Microbial Ecology, 2000. Editors: Schink, Bernhard (Ed.)
Jansson, Mats. "Phosphate uptake and utilization by bacteria and algae." Hydrobiologia 170.1 (1988): 177-189.
Kamjunke, Norbert, Birgit Köhler, and Nicola Wannicke. "Algae as competitors for glucose with heterotrophic bacteria." Journal of phycology 44.3 (2008): 616-623.
Katechakis, Alexis, et al. "Mixotrophic versus photoautotrophic specialist algae as food for zooplankton: The light: nutrient hypothesis might not hold for mixotrophs." Limnology and Oceanography 50.4 (2005): 1290-1299.
Kim, Ho-Sub, et al. "Effects of limiting nutrients and N: P ratios on the phytoplankton growth in a shallow hypertrophic reservoir." Hydrobiologia 581.1 (2007): 255-267.
Körtzinger, Arne, et al. "C: N ratios in the mixed layer during the productive season in the northeast Atlantic Ocean." Deep Sea Research Part I: Oceanographic Research Papers 48.3 (2001): 661-688.
Kuznetsov, I., T. Neumann, and H. Burchard. "Model study on the ecosystem impact of a variable C: N: P ratio for cyanobacteria in the Baltic Proper." Ecological Modelling 219.1 (2008): 107-114.
Lee, Young Sik, et al. "Limiting nutrients of phytoplankton community in Hiroshima Bay, Japan." Water Research 30.6 (1996): 1490-1494.
Loladze, Irakli, and James J. Elser. "The origins of the Redfield nitrogen‐to‐phosphorus ratio are in a homoeostatic protein‐to‐rRNA ratio." Ecology letters 14.3 (2011): 244-250.
Lomas, M. W., and P. M. Glibert. "Interactions between NH+ 4 and NO− 3 uptake and assimilation: comparison of diatoms and dinoflagellates at several growth temperatures." Marine Biology 133.3 (1999): 541-551.
Watermann, Frank, et al. "Competition between benthic cyanobacteria and diatoms as influenced by different grain sizes and temperatures." Marine Ecology Progress Series(1999): 77-87.
Pahlow, Markus. "Linking chlorophyll–nutrient dynamics to the Redfield N: C ratio with a model of optimal phytoplankton growth." Marine Ecology Progress Series 287 (2005): 33-43.
Nõges, Tiina, et al. "Critical N: P ratio for cyanobacteria and N2-fixing species in the large shallow temperate lakes Peipsi and Vortsjärv, North-East Europe." Hydrobiologia 599.1 (2008): 77-86.
Van Niel, Ed WJ, et al. "Competition between heterotrophic and autotrophic nitrifiers for ammonia in chemostat cultures." FEMS Microbiology Ecology 11.2 (1993): 109-118.
Nils, Risgaard-Petersen. "Coupled nitrification‐denitrification in autotrophic and heterotrophic estuarine sediments: on the influence of benthic microalgae." Limnology and Oceanography 48.1 (2003): 93-105.
Perrin, Chris J., Max L. Bothwell, and Pat A. Slaney. "Experimental enrichment of a coastal stream in British Columbia: effects of organic and inorganic additions on autotrophic periphyton production." Canadian journal of fisheries and aquatic sciences 44.6 (1987): 1247-1256.
Rocha, C., H. Galvão, and A. Barbosa. "Role of transient silicon limitation in the development of cyanobacteria blooms in the Guadiana estuary, south-western Iberia." Marine Ecology Progress Series 228 (2002): 35-45.
Shaffer, Gary. "Redfield ratios, primary production, and organic carbon burial in the Baltic Sea." Deep Sea Research Part A. Oceanographic Research Papers 34.5-6 (1987): 769-784.
Smith, Val H., and Susan J. Bennett. "Nitrogen: phosphorus supply ratios and phytoplankton community structure in lakes." Archiv für Hydrobiologie-Hauptbände (1999): 37-53.
Stelzer, Robert S., and Gary A. Lamberti. "Effects of N: P ratio and total nutrient concentration on stream periphyton community structure, biomass, and elemental composition." Limnology and Oceanography 46.2 (2001): 356-367.
Tanaka, Tsuneo, Fereidoun Rassoulzadegan, and T. Frede Thingstad. "Orthophosphate uptake by heterotrophic bacteria, cyanobacteria, and autotrophic nanoflagellates in Villefranche Bay, northwestern Mediterranean: Vertical, seasonal, and short‐term variations of the competitive relationship for phosphorus." Limnology and Oceanography 49.4 (2004): 1063-1072.
Townsend, S. A., et al. "Does the Redfield ratio infer nutrient limitation in the macroalga Spirogyra fluviatilis?." Freshwater Biology 53.3 (2008): 509-520.